乾電池は、化学電池です。
化学電池:化学エネルギーを電気エネルギーにかえる装置。
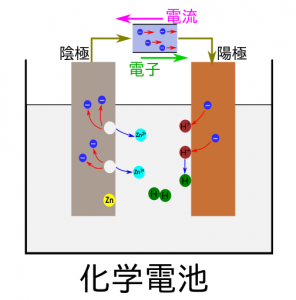
中学理科で学習する化学電池は、陰極では、電解質溶液に金属が溶け出し、電子を放出してイオンになることを利用しています。(陰極=−極、陽極=+極)
うすい塩酸(電解質)に銅板と亜鉛板を入れ、化学電池のし組みを説明します。
- 陰極(亜鉛):電子を放出し、亜鉛が溶ける
- 電子が移動
- 陽極(銅板):電子を受けとり、水素が発生する
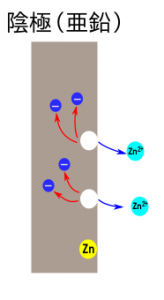
1.陰極(亜鉛):電子を放出し、亜鉛が溶ける
亜鉛のほうが、銅より、イオンになりやすいので、亜鉛が亜鉛イオン(Zn2+)となって、溶け出す。
同時に、電子を2個放出する。(![]() :電子)
:電子)
陰極での化学変化をイオン式で表すと、
(Zn:亜鉛原子、Zn2+:亜鉛イオン、e−:電子)
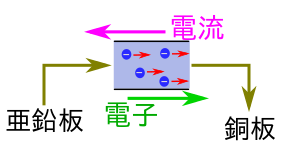
2.電子が移動
亜鉛板と銅板を導線で接続すると、その中を電子が流れて銅板へ移動する。
このとき、電子が多くたまっていた亜鉛板が陰極で、流れていく先の銅板が陽極になる。
- 電子は陰極から陽極へ流れる。
- 電流は陽極から陰極へ流れる。
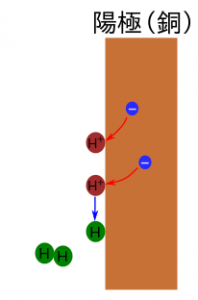
3.陽極(銅板):電子を受けとり、水素が発生する
陽極(銅板)に移動した電子を水素イオン(H+)が受けとり、水素原子になる。水素原子は2個結びつき、水素分子H2となり、気体(あわ)になって空気中へ出ていく。
陽極での化学変化をイオン式で表すと、
(H+:水素イオン、H2:水素分子)
【まとめ】
<化学電池>
【陰極】 Zn → Zn2+ + 2e−(電子を放出する化学変化)
【陽極】 2H+ + 2e− → H2(電子を受け取る化学変化)
- 電子は、陰極から陽極へ流れる
- 電流は、陽極から陰極へ流れる
<化学電池の種類>
- 乾電池
- 蓄電池(バッテリー)
- 燃料電池
マンガン乾電池やアルカリ乾電池は、陰極に 亜鉛が使われています。陽極は二酸化マンガンです。
(アルカリ電池の電解質は、水酸化ナトリウム(アルカリ性))
化学電池として利用できる金属は、異なる種類の金属です。同じ種類の金属では化学電池はできません。
ボタン電池(コイン電池)は乾電池の一種で、その形から名付けられているようです。
(ちなみに、ボタン電池の蓄電池も存在するが一般には販売されていない。)







とても分かりやすく、理解することが出来ました。本当にありがとうございます。
ありがとうございました。勉強頑張ってください。応援しています。