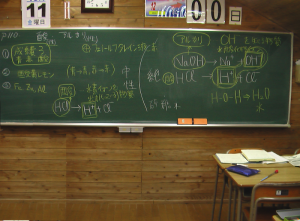酸:電離(でんり)するとH+(水素イオン)を出す物質。
(例)塩化水素(塩酸)
HCl → H+ + Cl-
塩酸 水素イオン 塩化物イオン
アルカリ:電離するとOH–(水酸化物イオン)を出す物質。
(例)水酸化ナトリウム水溶液
NaOH → Na+ + OH–
水酸化ナトリウム ナトリウムイオン 水酸化物イオン
酸性:
- すっぱい
- H+が存在
- 青色リトマス紙を赤に
- BTB溶液が黄に
- 亜鉛やマグネシウムなどの金属と反応して水素を発生
アルカリ性:
- にがい
- OH–が存在
- 赤色リトマス紙を青に
- BTB溶液が青に
- フェノールフタレイン液が赤に
酸性の液体>(〜酸で終わる)塩酸、硫酸、硝酸、酢酸(さくさん、お酢)、炭酸
アルカリ性の液体>(水酸化〜で始まる)
アンモニア水、石灰水、水酸化ナトリウム水溶液、水酸化バリウム水溶液、水酸化カルシウム水溶液、
【番外】
中性では、
- 赤色リトマス紙は赤のまま、青色リトマス紙は青のまま
- BTB溶液は緑色